-
뇌수막염이란?
사람의 뇌와 척수는 뇌척수막이라는 세 겹의 막으로 둘러싸여 보호받고 있습니다.1
이러한 뇌척수막에 여러 원인으로 염증이 발생한 것을 뇌수막염이라 합니다.1

-
뇌수막염은 왜 발생하나요??
대부분의 뇌수막염은 감염성으로 바이러스, 세균, 진균, 기생충과 같은 미생물이 혈액을 통해 뇌척수액에 침입하여 발생합니다.1

-
세균성 뇌수막염의 원인균, 수막구균
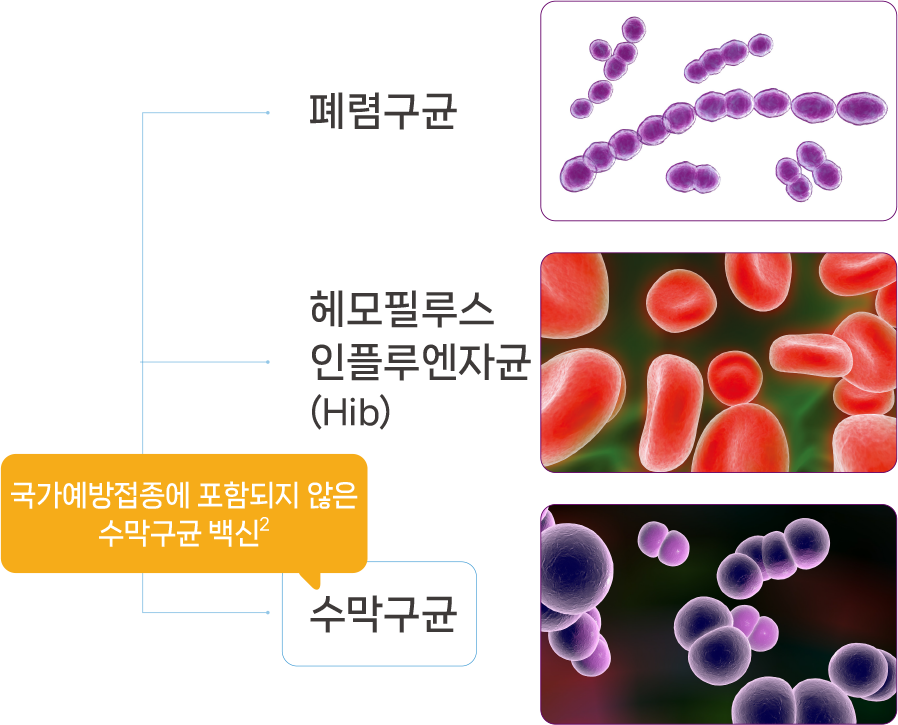
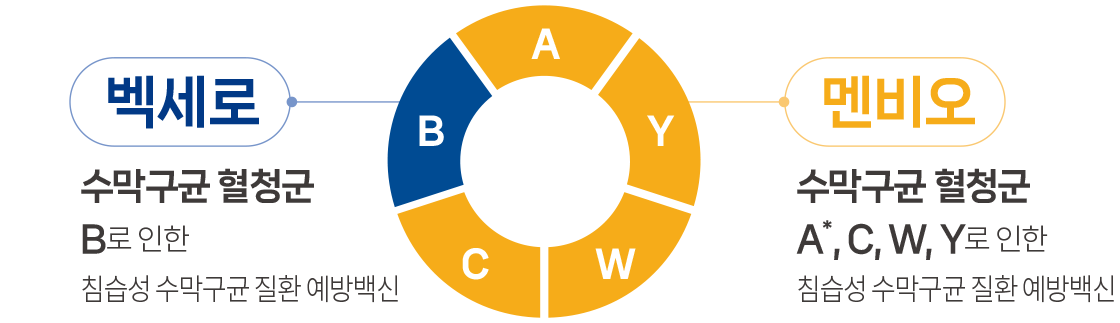
세균성 뇌수막염의 원인균은 수막구균, 폐렴구균, B형 헤모필루스 인플루엔자균(Hib) 입니다.1 이 중 폐렴구균 및 Hib와 달리, 수막구균 백신은 어린이 국가예방 접종(NIP)에 포함되지 않습니다.2
 Hib, hemophilus influenze type b; NIP, National
Immunization Program.
Hib, hemophilus influenze type b; NIP, National
Immunization Program.

-
수막구균 감염은 언제 많이 발생하나요?
2022년 질병관리청 수막구균 감염증 관리지침에서 신생아는 생후 6개월에서 2세 사이에 모체로부터 받은 항체역가가 최저점이 되며, 이 시기가 수막구균 감염의 호발 시기와 일치한다고 밝혔습니다.3
-
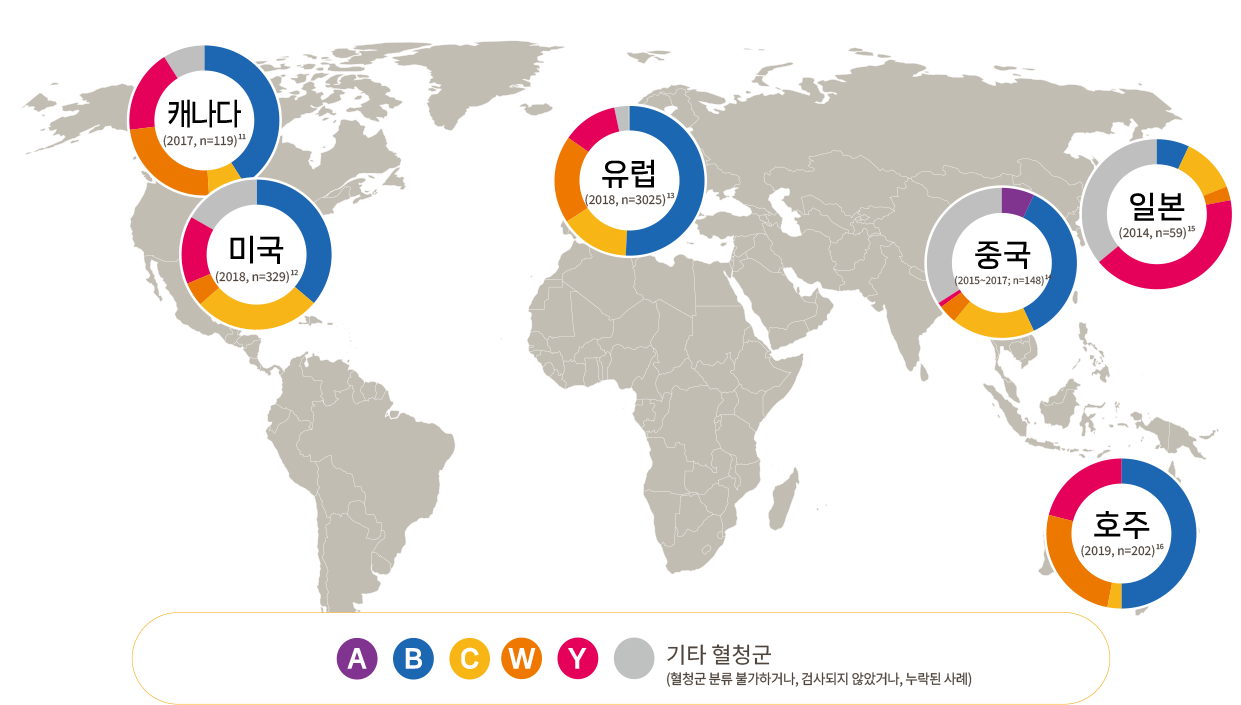
수막구균 감염의 국내 발생 현황
국내 수막구균 감염증의 23년간 누적 보고(224건)를 분석한 결과, 12개월 미만 영아에서 가장 많이 발생(19건)하였습니다.4 (조회기간: 2001년 1월 1일~2023년 12월 31일)
침습성 수막구균 질환은 증상만으로 초기 진단이 어렵고
빠르게 진행되어 24시간 이내에 사망할 수도 있습니다.5,6
두통
경부 경직
발열
오심 / 구토
의식 저하
이스라엘에서 발표된 연구 결과에 따르면,
침습성 수막구균 질환에서 생존한 어린이 115명
중 38명(33%)은
최소 1가지 이상의 장기적인 후유증을 경험했습니다.7


* 1991년-2010년동안 이스라엘의 만 15세 미만 어린이에서 발생한 침습성 수막구균 질환에 대한 연구, follow-up 설문지에 기반하여 IMD 질환으로부터 생존한 어린이 부모에게 전화로 정보 취합7

 질병관리청, 예방접종의 실시기준과
방법(2023)9
질병관리청, 예방접종의 실시기준과
방법(2023)9
수막구균 감염으로 인한 사망은 절반 정도가 발병 1일 이내에 생길 정도로 빠른 경과를 보이기 때문이며, 임상적으로 의심이 되면 바로 항생제를 투여하는 것 외에 백신을 접종하여 감염증 발생을 예방하는 것이 최선이다.
최근 국내 수막알균 감염의 혈청군 B의 비율이 증가하는 것을 고려하면 혈청군 B에 대한 예방접종의 도입이 필요하다.

2~23개월 영유아
생후 2개월 ~ 만 10세 (해부학적 또는 기능적 무비증 환자 및 보체결핍증)
수막구균 감염은 다른 연령대 대비 2세 미만 영아에서 많이 발생하므로 의사와 상의 하에 부모가 선택하여 접종할 수 있습니다.

유학/기숙사 생활을
주로 하는 청소년

수막구균 감염의
위험이 높은 사람
(발생율이 높거나 유행하는 지역* 거주자 또는 여행자)
*아프리카 수막염 벨트 여행자, 사우디 아라비아 메카 순례자,기타 수막구균이 유행인 지역
- 질병관리청 국가건강정보포털. 뇌수막염. Available at https://health.kdca.go.kr/healthinfo/biz/health/gnrlzHealthInfo/gnrlzHealthInfo/gnrlzHealthInfoView.do?cntnts_sn=5284 Accessed Apr. 2024.
- 질병관리청. 어린이 국가예방접종 지원사업. Available at https://nip.kdca.go.kr/irhp/infm/goVcntInfo.do?menuLv=1&menuCd=131 Accessed Apr. 2024.
- 질병관리청. 2022년 수막구균 감염증 관리지침
- 질병관리청 감염병포털. 수막구균감염증. Available at https://dportal.kdca.go.kr/pot/is/age.do Accessed Apr. 2024.
- WHO meningitis fact sheet. Available at https://www.who.int/news-room/fact-sheets/detail/meningitis Accessed Apr. 2024
- Thompson MJ, et al. Lancet. 2006;367(9508):397-403.
- Stein-Zamir C, et al. Pediatr Infect Dis J. 2014;33(7):777-9.
- 질병관리청. 정책정보>감염병>감염병감시체계>국가감염병감시사업안내 (최종검토일: 2024.01.15). Available at https://www.kdca.go.kr/contents.es?mid=a20301110100. Accessed Apr. 2024.
- 질병관리청. 예방접종의 실시기준과 방법. 2023.
- de Santayana CP, et al. Epidemiol Infect. 2023;151:e57.
- Canada: Public Health Agency of Canada, 2020. Vaccine preventable disease: surveillance report to December 31, 2017.
- USA: Centers for Disease Control and Prevention (CDC), 2018. Enhanced meningococcal disease surveillance report, 2018.
- Europe: European Centre for Disease Prevention and Control (ECDC). Invasive meningococcal disease - Annual Epidemiological Report for 2018. Available at https://www.ecdc.europa.eu/sites/default/files/documents/AER-Invasivemeningococcal-disease-2018.pdf Accessed May. 2024.
- China: Li JH, et al. Zhonghua Yu Fang Yi Xue Za Zhi. 2019;53(2):159-163.
- Japan: Fukusumi M, et al. Vaccine. 2016 Jul 25;34(34):4068-71.
- Australia: Lahra MM, et al. Commun Dis Intell (2018). 2020 Aug 17;44.
- EMA. Home > Medicines > Bexsero. Available at https://www.ema.europa.eu/en/medicines/human/EPAR/bexsero. Accessed Apr. 2024.
- Sulis G, et al. Vaccine. 2022 Jun 9;40(26):3647-3654.
- ECDC. Factsheet about meningococcal disease. Available at https://www.ecdc.europa.eu/en/meningococcal-disease/factsheet Accessed Apr. 2024.
- Martinón-Torres F, et al. Pathog Glob Health. 2022 Mar;116(2):85-98.
- Mbaeyi SA, et al. MMWR Recomm Rep 2020;69(No. RR-9):1–41.
- IQVIA 2023년. 전 세계 판매량 기준. Meningococcal Vaccine 부문(J07D2) 내 Men ACWY 항목
- Deceuninck G, et al. Vaccine. 2019;37(31):4243-4245.
- Watson PS, et al. Vaccine. 2016;34(7):875-880.
- Rodrigues FMP, et al. JAMA. 2020;324(21):2187-2194.
- Ladhani SN, et al. N Engl J Med. 2020;382(4):309-317.
- Azzari C, et al. Vaccines (Basel). 2020;8(3):469
- Castilla J, et al. N Engl J Med.2023;388(5):427-438
- McMillan M, et al. Clin Infect Dis. 2021;73(1):e233-e237.
- Halperin SA, et al. Eur J Clin Microbiol Infect Dis. 2010 Mar;29(3):259-67.
- Jackson LA, et al. Clin Infect Dis. 2009 Jul 1;49(1):e1-10
- Jacobson RM, et al. Pediatr Infect Dis J. 2013 Apr;32(4):e170-7.
- Read RC, et al. Lancet. 2014 Dec 13;384(9960):2123-31.
- Im JH, et al. Vaccine. 2020;38(4):730-732.
- 질병관리청. 예방접종 주의사항 및 금기사항. Available at https://nip.kdca.go.kr/irhp/infm/goVcntInfo.do?menuLv=1&menuCd=114 Accessed Apr. 2024.
- European Centre for Disease Prevention and Control. Invasive meningococcal disease - Annual Epidemiological Report for 2017. ECDC; 2019.
- Harrison LH, et al. Vaccine. 2011 Apr 18;29(18):3363-71.
- Zhou J, et al. J Clin Microbiol. 2012 May;50(5):1545-51.
- Parikh SR, et al. J Infect. 2020 Oct;81(4):483-498. 29
- Centers for Disease Control and Prevention. Meningococcal vaccination for adolescents: information for healthcare professionals. Available at https://www.cdc.gov/vaccines/vpd/mening/hcp/adolescent-vaccine.html Accessed Apr. 2024.
- American Academy of Pediatrics. Common Immunization Questions from Parents. Available at https://www.aap.org/en/patient-care/immunizations/communicating-with-families-and-promoting-vaccine-confidence/commonimmunization-questions-from-parents/ Accessed Apr. 2024.
- Pelton SI. J Adolesc Health. 2010;46:S9–S15.
- American Academy of Pediatrics. Multiple vaccinations at one time. Available at https://www.healthychildren.org/English/safety-prevention/immunizations/pages/Multiple-Vaccinations-at-One-Time.aspx Accessed Apr. 2024.
- European Centre for Disease Prevention and Control. Expert opinion on the introduction of the meningococcal B (4CMenB) vaccine in the EU/EEA. ECDC;2017. Available at https://www.ecdc.europa.eu/en/publications-data/expertopinionintroduction-meningococcal-b-4cmenb-vaccine-eueea Accessed Apr. 2024.
- Government of South Australia. Meningococcal vaccines. Available at https://www.sahealth.sa.gov.au/wps/wcm/connect/public+content/sa+health+internet/conditions/immunisation/vaccines/meningococcal+vaccines/ meningococcal+vaccines Accessed Apr. 2024.
- Diário da República, 2ª série – PARTE C. SAÚDE – Gabinete do Secretário de Estado da Saúde. Despacho nº12434/2019. Available at https://dre.pt/application/conteudo/127608823 Accessed Apr. 2024.
- Martinón-Torres. J Adolesc Health. 2016 Aug;59(2 Suppl):S12-20.
- Bekkat-Berkani R, et al. J Infect. 2022 Nov;85(5):481-491.
- 질병관리청. 예방접종대상 감염병의 역학과 관리 제5판. 2017
- IQVIA 2023년. 전 세계 판매량 기준. Meningococcal Vaccine 부문(J07D2) 내 Meningococcal Vaccine B 항목
- 제품정보
- 벡세로프리필드시린지(수막구균B군흡착백신(유전자재조합,외막소포))
- 원료약품 및 분량
-
1프리필드시린지(0.5 밀리리터) 중
1. 재조합수막구균B군NHBA융합단백질(rp287-953,숙주:E.coli BL21(DE3),
벡터:△G287NZ-953-K) 50마이크로그램
2. 재조합수막구균B군NadA단백질(rp961c, 숙주:E.coli BL21(DE3), 벡터:961cL-K) 50마이크로그램
3. 재조합수막구균B군fHBP융합단백질(rp936-741, 숙주:E.coli BL21(DE3), 벡터:936-741-K) 50마이크로그램
4. 수막구균B군NZ98/254균주외막소포(OMV, 균주:N.meningitidis NZ98/254) 25마이크로그램
첨가제 : 히스티딘, 수산화알루미늄, 주사용수, 염화나트륨, 백당
- 효능 • 효과
- 생후 2개월 이상에서 Neisseria meningitidis B군에 의한 침습성 수막구균 질환의 예방
- 용법 • 용량
-
생후 2개월 ~ 5개월의 영아는 1회 0.5mL씩 최소 1개월의 간격을 두고 총 3회 또는 최소 2개월의 간격을 두고 2회 기초접종한다.
생후 6개월 ~ 23개월의 영아는 1회 0.5mL씩 최소 2개월의 간격을 두고 총 2회 기초접종한다.
생후 2개월 ~ 23개월의 영아는 추가접종이 필요하다.
만 2세 이상의 소아 및 성인은 1회 0.5mL씩 최소 1개월의 간격을 두고 총 2회 기초접종한다.
1. 다음 환자에는 투여하지 말 것: 이 백신의 주성분, 첨가제, 또는 이 백신의 이전 접종에 과민증이 있는 자 2. 다음 환자에는 신중히 투여할 것: 다른 백신과 마찬가지로, 급성 중증 열성 질환이 있는 자는 이 백신의 접종을 연기해야 한다. 그러나 감기와 같은 경미한 감염으로 인해 접종이 연기되어서는 안 된다. 3. 이상반응: 1) 안전성 프로파일 요약 이 백신의 안전성은 이 백신을 최소 한 번 접종 받은 10565 명의 시험대상자(생후 2개월 이상의 연령)가 참여한 17개의 연구를 통하여 평가되었다. 이 백신을 접종 받은 대상자들 중에서, 6837명은 만 2세 미만 영아, 1051명은 만 2세 ~ 만 10세 소아, 2677명은 만 11세 이상 소아 및 성인이었다. 영아 기초접종을 이 백신으로 접종 받은 시험대상자들 중에서 3285명이 생후 12개월 ~ 24개월에 추가접종을 받았다. 임상시험에서 관찰된 만 2세 미만의 영아들에게서 가장 흔한 약물이상반응은 주사부위의 압통, 홍반, 발열, 자극 과민성이었다. 생후 2, 4, 6개월에 백신을 접종 받은 영아를 대상으로 수행한 임상시험에서 발열(≥38°C)의 발생률은 일상적으로 접종하는 백신들(7가 폐렴구균 접합, 디프테리아, 파상풍, 정제 백일해, B형 간염, 불활화 폴리오 및 헤모필루스 인플루엔자 b형 항원 함유)을 이 백신과 동시 접종했을 때 69%-79% 였고, 일상적으로 접종하는 백신을 단독 접종했을 때 44%-59% 였다. 해열제를 사용한 비율도 이 백신과 일상적으로 접종하는 백신을 동시 투여한 경우 더 높았다. 이 백신을 단독으로 투여한 경우, 발열의 발생률은 임상시험 기간 동안 영아에게 일상적으로 접종하는 백신들을 투여한 경우와 유사하였다. 발열은 대부분 접종 하루 만에 사라졌으며 예측 가능한 양상을 보였다. 만 11세 이상 소아와 성인에서 관찰된 가장 흔한 약물이상반응은 주사부위 통증, 권태, 및 두통이었다. 백신 접종 일정을 진행하는 동안 약물이상반응의 발생률 또는 중증도가 증가하지 않았다. 2) 임상시험 임상시험에서 보고된 백신접종과 관련성이 있을 것으로 판단된 약물이상반응(기초접종 또는 추가접종 후)을 발생 빈도 별로 제시하였다. 보고된 약물이상반응은 다음 빈도 용어를 따른다. 매우 흔하게 (very common): ≥1/10, 흔하게 (common): ≥1/100 및 <1/10, 때때로 (uncommon): ≥1/1,000. 만 10세 이하 영아 및 소아 ①대사 및 영양 장애 - 매우 흔하게: 식이 장애 ②각종 신경계 장애 - 매우 흔하게: 졸림, 비정상적 울음, 두통 등 ③각종 혈관 장애 - 때때로: 창백 등 ④각종 위장관 장애 - 매우 흔하게: 설사, 구토(추가접종 후에는 때때로) ⑤피부 및 피하 조직 장애 - 매우 흔하게: 발진(생후 12개월~23개월의 영아) (추가접종 후에는 때때로) 등 ⑥근골격 및 결합 조직 장애 - 매우 흔하게: 관절통 ⑦전신 장애 및 투여 부위 병태 - 매우 흔하게: 열(≥38°C), 주사부위 압통(주사부위 사지를 움직일 때의 울음으로 정의된 중증의 주사부위 압통 포함), 주사부위 홍반 등. 만 11세 이상 소아 및 성인 ①각종 신경계 장애 - 매우 흔하게: 두통 ②각종 위장관 장애 - 매우 흔하게: 오심 ③근골격 및 결합 조직 장애 - 매우 흔하게: 근육통, 관절통 ④전신 장애 및 투여 부위 병태 - 매우 흔하게: 주사부위 통증(일상적인 활동을 수행할 수 없는 상태로 정의된 중증의 주사부위 통증 포함), 주사부위 종창 등. 4. 일반적 주의: 1) 일반적 주의 이 백신은 정맥주사, 피하주사, 피내주사 또는 혈관내 주사해서는 안 된다. 모든 백신 주사제와 마찬가지로, 백신 접종 후 아나필락시스 사례가 일어날 경우를 대비하여 적절한 의학적 치료와 감독이 항상 준비되어 있어야 한다. 근육 내 투여가 금기인 혈소판 감소증이나 다른 응고장애가 있는 사람에게는 잠재적 유익성이 투여로 인한 위험성보다 명백하게 높을 경우를 제외하고 이 백신을 투여해서는 안 된다. 다른 백신과 마찬가지로, 모든 접종자에게 예방효과가 나타나는 것은 아니다. 이 백신은 발생하고 있는 모든 수막구균 B군 균주에 대한 예방 효과를 나타낼 것으로 예상되지는 않는다. 면역 억제 요법, 유전적 장애, 또는 다른 원인들로 인하여 면역력이 약화된 환자에서 능동 면역에 대하여 감소된 항체 반응을 나타낼 수 있다. 5. 임부, 수유부에 대한 투여: 임부 및 수유부에 대한 임상자료는 충분하지 않다. 임부 및 수유부에게 백신 접종을 결정하기 전에 유익성-위험성을 반드시 평가하여야 한다.
- 최종허가변경일: 2024-07-04 - 이 개정일자 이후 변경된 내용 및 제품 정보 전문은 kr.gsk.com에서 확인하실 수 있습니다.
- 제품정보
- 멘비오[(수막구균 A,C,W135,Y)- CRM197단백 접합 백신]
- 원료약품 및 분량
-
용해 후 1회 용량(0.5 mL) 중 - 바이알 1(MenA 동결건조접합체)
1. 수막구균 A군 올리고당과 디프테리아 CRM197 단백질 접합체, 수막구균 A군 올리고당으로서 10마이크로그램 (디프테리아 CRM197 단백질분량 16.7~33.3마이크로그램)
첨가제 : 인산이수소칼륨, 백당
용해 후 1회 용량(0.5 mL) 중 - 바이알 2(MenCWY 액상접합체)
1. 수막구균 C군 올리고당과 디프테리아 CRM197 단백질 접합체, 수막구균 C군 올리고당으로서 5마이크로그램 (디프테리아 CRM197 단백질분량 7.1~12.5 마이크로그램)
2. 수막구균 W135군 올리고당과 디프테리아 CRM197 단백질 접합체, 수막구균 W135군 올리고당으로서 5마이크로그램 (디프테리아 CRM197 단백질분량 3.3~8.3 마이크로그램)
3. 수막구균 Y군 올리고당과 디프테리아 CRM197 단백질 접합체, 수막구균 Y군 올리고당으로서 5마이크로그램 (디프테리아 CRM197 단백질분량 5.6~10 마이크로그램)
첨가제 : 주사용수, 염화나트륨, 인산수소이나트륨이수화물, 인산이수소나트륨일수화물
- 효능 • 효과
- 생후 2개월 이상의 소아 ~ 만 55세 이하의 성인에서 Neisseria meningitidis A, C, W135 및 Y 군에 의한 침습성 수막구균 질환의 예방. (단, 생후 2개월~생후 23개월의 영아에서 Neisseria meningitidis A군의 효능효과는 입증되지 않음)
- 용법 • 용량
-
1회 0.5 mL을 근육주사한다.
주사부위는 영아의 경우 대퇴부 전외측에 하고, 어린이와 청소년 및 성인의 경우 상완부 삼각근에 한다.
연령대별 접종방법은 다음과 같다.
생후 2개월~생후 23개월의 영아- 접종을 시작하는 생후 2개월부터 생후 6개월까지 영아의 경우 처음 3회 접종을 각각 0.5mL씩 최소 2개월의 간격을 두고 접종하고, 4차 접종은 적어도 6개월 간격을 두고 만 1세 이후에 실시한다.- 이 백신 접종 경험이 없는 생후 7개월~생후 23개월의 영아의 경우 0.5mL 씩 총 2회 접종을 한다.만 2세 이상의 소아 ~ 만 55세 이하의 성인의 경우 0.5mL을 1회 접종한다.
두 번째 접종은 첫 번째 접종 후 최소 3개월의 간격을 두고 만 1세 이후에 실시한다.
1. 다음 환자에는 투여하지 말 것: 1) 활성 성분 및 디프테리아 톡소이드(CRM197)를 포함한 다른 성분에 과민성이 있거나 과거에 비슷한 성분을 함유한 백신을 투여한 후 생명을 위협하는 반응이 있었던 경우 2. 다음 환자에는 신중히 투여할 것: 1) 이 백신은 혈소판감소증 환자, 출혈 장애 환자 및 혈종의 위험 때문에 항응고 요법을 받고 있는 환자에서는 평가되지 않았다. 보건의료전문가가 혈종의 위험이 있는 사람의 경우 근육 주사 후의 위험-혜택에 대한 비율을 평가해야 한다. 2) 다른 백신들과 마찬가지로, 급성 중증 발열성 질환이 있는 환자는 이 백신 투여를 연기해야 한다. 경미한 감염은 접종 연기 사유는 아니다. 3. 이상반응: ◯ 임상시험에서 나타난 이상사례: 각 빈도 군 내에서, 바람직하지 않은 반응은 중대성 내림차순으로 제시되어 있다. 빈도는 다음과 같이 정의된다: • 매우 흔함(Very common): (≥ 1/10) • 흔함(Common): (≥ 1/100에서 <1/10) 생후 2개월~생후 23개월의 영아: 이 백신을 투여한 생후 2개월 된 영아 참가자 8,735명을 대상으로 필수접종 백신과의 병용투여 무작위배정 다기관 대조 임상 시험을 통해 이 백신의 4회 접종 계획에 대한 안전성을 평가하였다. 주사부위 압통, 과민성, 졸음이 가장 흔하였다. 이 백신의 2회 접종 계획에 대한 안전성은 생후 2개월~생후 23개월 된 2,180명의 영아를 대상으로 하는 4건의 임상연구에서 필수접종 백신과의 병용투여 무작위배정 임상시험을 통해 평가되었다. 관찰된 이상사례는 다음과 같다. 대사 및 영양 장애: - 매우 흔함: 식이 장애. 신경계 장애: - 매우 흔함: 지속적 울음, 졸음. 위장관계 장애: - 매우 흔함: 설사, 구토. 피부 및 피하조직 장애: - 흔함: 발진. 전신 장애 및 투여부위 상태: - 매우 흔함: 과민성, 주사부위 압통, 주사부위 홍반(≤50 mm), 주사부위 경결(≤50 mm) 등. 생후 2개월 ~ 생후 23개월의 영아 피험자 12,049명 및 대조군 2,877명을 대상으로 임상시험을 한 결과 중대한 이상사례는 다음과 같다. 1) 사망: 시험군에서 2건 발생하였다. 그 중 1건은 영아 돌연사, 1건은 패혈성 쇼크에 의한 사망이였으며, 백신과의 인과관계가 없는 것으로 간주된다. 2) 가와사키병: 가와사키병은 총 6건이 발생하였으며, 시험군 5건, 대조군 1건이다. 시험군에서 발생한 5건 중 2건은 백신과의 인과관계가 없으며, 3건은 백신과의 인과관계의 가능성이 있다. 3) 발열성 경련: 발열성 경련은 시험군에서 총 4건이 발생하였으며, 백신과의 인과 관계의 가능성이 있다. 이 중 3건은 MMRV(ProQuad)와 동시 접종시 발병하였다. 4) 급성파종성 뇌척수염: 급성파종성 뇌척수염은 시험군에서 총 1건이 발생하였으며, 백신과의 인과관계 가능성이 있다. 본 건은 엠엠알II, 바리박스, 프리베나 및 하브릭스와 동시 접종하였다. 5) 그 외 중대 이상사례: 간질, 심실상 빈맥, 완전 부분 발작, 발열 및 서혜부 농양의 경우 시험군에서 각각 1건 발생하였으며 백신과의 인과관계 가능성이 있다. 또한 특발성 혈소판감소 자색반의 경우 시험군에서 1건 발생하였으며, 백신과의 인과관계가 있다. 만 2세 ~ 만 10세의 어린이: 1) 만 2세 ~ 만 10세 어린이에 대한 이 백신의 안전성 프로파일 특성은 이 백신을 투여받은 3,181명을 대상으로 하는 4건의 임상연구 자료에 근거하였다. 국소 및 전신반응과 다른 이상사례의 반응률은 이 백신과 비교백신들(MenACWY-diphtheria toxoid 결합백신 또는 MenACWY 다당백신) 간에 대체로 유사하였다. 2) 이들 임상시험 동안 가장 흔한 이상사례는 일반적으로 하루에서 이틀 동안 지속되었으며 중증이지 않았다. 이들 이상사례는 다음과 같다. 대사 및 영양 장애: - 흔함: 식이 장애. 신경계 장애: - 매우 흔함: 졸음, 두통. 위장관계 장애: - 흔함: 오심, 구토, 설사. 피부 및 피하조직 장애: - 흔함: 발진. 근골격계 및 결합조직 장애: - 흔함: 근육통, 관절통. 전신 장애 및 투여부위 상태: - 매우 흔함: 과민성, 권태감, 주사부위 통증, 주사부위 홍반(≤50 mm), 주사부위 경결(≤50 mm) 등. 만 11세 ~ 만 65세의 청소년 및 성인: 1) 청소년과 성인에게서의 이 백신의 안전성 프로파일 특성은 이 백신을 투여받은 6,401명의 피험자(만 11세 ~ 만 65세)를 대상으로 하는 무작위배정 대조 임상연구 5건에서 얻은 자료에 근거하였다. 2) 국소, 전신, 및 기타 반응의 발생률과 중증도는 모든 연구들에 걸쳐 이 백신군에서 그리고 청소년군과 성인군 내에서 전반적으로 유사하였다. 3) 임상 연구에서 관찰된 가장 흔한 국소 및 전신 이상사례는 주사부위 통증과 두통이었다. 4) 중추적 임상 연구 3건과 뒷받침 연구 2건에서 보고된 이상사례는 아래에 신체기관계(SOC) 별로 나열하였다. 임상 연구들에서 보고된 가장 흔한 부작용은 보통 1-2일 정도만 지속되었고 중증이 아니었다. 신경계 장애: - 매우 흔함: 두통 등. 위장관계 장애: - 매우 흔함: 오심. 피부 및 피하조직 장애: - 흔함: 발진. 근골격계 및 결합조직 장애: - 매우 흔함: 근육통, - 흔함: 관절통. 전신 장애 및 투여부위 상태: - 매우 흔함: 주사부위 통증, 주사부위 홍반(≤50 mm), 주사부위 경결(≤50 mm), 권태감 등. 5) 청소년 연령군에서는 백신의 안전성과 내약성이Td ap에 비해 바람직하였으며 다른 백신과의 병용 투여 또는 순차적 투여 시에 큰 변화가 없었다. 4. 일반적 주의: 1) 어떤 백신이라도 투여 전에 투여 담당자는 자세한 병력 및 현재 건강 상태 조사를 포함하여 알러지 반응 또는 기타 모든 반응의 예방을 위해 알려진 모든 주의 사항을 취해야 한다. 모든 주사제 백신과 마찬가지로, 백신 투여 후 드물게 아나필락시스 반응이 발생하는 경우를 대비하여 항상 적절한 내과적 치료와 감독이 신속하게 이루어져야 한다. 2) 정맥주사, 피하주사 또는 피내주사로 투여해서는 안된다. 3) 한 번에 두 가지 이상의 백신을 투여하는 경우, 서로 다른 주사부위를 사용해야 한다. 4) 이 백신은 백신에 함유되지 않은 다른 혈청군의 N. meningitidis에 의한 감염에 대해서는 보호 작용을 나타내지 않는다. 5. 임부, 수유부에 대한 투여: 임부 및 수유부를 대상으로 한 대조임상은 없다. 해당 약물은 명백히 필요한 경우에만 임부에게 접종해야 한다.
– 최종허가변경일: 2024-05-14 – 이 개정일자 이후 변경된 내용 및 제품 정보 전문은 kr.gsk.com에서 확인하실 수 있습니다.



 * 단, 생후 2개월~생후 23개월의 영아에서 Neisseria meningitidis A군의 효능효과는 입증되지 않음
* 단, 생후 2개월~생후 23개월의 영아에서 Neisseria meningitidis A군의 효능효과는 입증되지 않음